
일반적으로 화학반응에 있어서 반응속도는 반응물의 농도에 따라 달라집니다. 따라서 반응물의 농도에 따른 화학반응의 속도를 식으로 나타내는데 이를 반응속도식이라고 합니다. 반응은 반응물의 차수에 따라 0차 반응, 1차 반응, 2차 반응으로 나뉘며 각 반응의 반응속도식은 다음과 같습니다.



0차 반응은 반응물의 차수가 0으로 결국 반응물의 농도와는 무관하게 반응이 일어납니다. 1차 반응은 반응물의 농도와 반응속도가 정비례하게 됩니다. 그리고 2차 반응은 반응물 농도의 제곱과 비례합니다.
이러한 반응물의 농도에 따른 반응 속도의 차이에 따라 반응물의 농도가 절반이 되는 시간인 반감기에도 차이가 생기게 되는데 이 반감기를 유도해보는 과정을 오늘 해볼 것입니다.
1. 0차 반응 반감기 유도
0차 반응 반감기는 유도할 것도 없는 당연한 내용입니다. 0차 반응의 반응 속도는 단순히 상수 K 이기 때문에 반응물의 농도 절반을 K로 나누어 주면 됩니다.

t초 후 A의 농도에 초기 농도를 빼면 이 값은 상수 K에 반응 시간 t를 곱해준 값의 음수 값일 것입니다.

반감기가 지난 후 A의 농도는 초기 농도의 절반 값입니다.



식을 전개하면 0차 반응의 반감기는 다음과 같습니다.
2. 1차 반응 반감기 유도


식을 전개해줍니다. 양변을 A의 농도로 나누고 양변에 반응 시간의 변화량을 곱해주었습니다.

그리고 양변을 0초부터 반응시간 t초까지 적분해줍니다.



t초를 반감기로 잡습니다. 그럼 t초후 A의 농도는 초기농도의 절반이 됩니다.
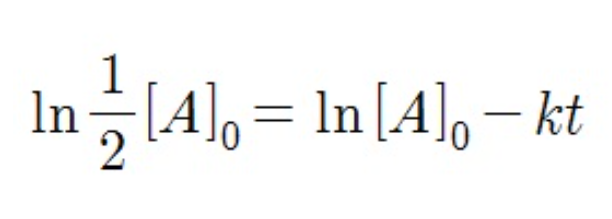
그리고 그대로 그 값을 대입해줍니다.
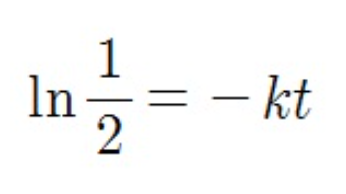
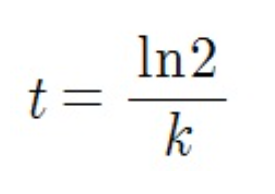
그래서 다 정리해주면 반감기 t는 상수값이 나옵니다! 즉 1차 반응에선 반응물의 농도와 상관없이 계속 반감기가 일정한 것을 알 수 있습니다. 같은 시간이 흐르면 같은 비율만큼 반응물의 농도가 감소하게 되는 것이죠.
3. 2차 반응 반감기 유도
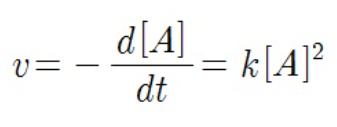
2차 반응의 속도는 반응물의 제곱에 비례합니다.
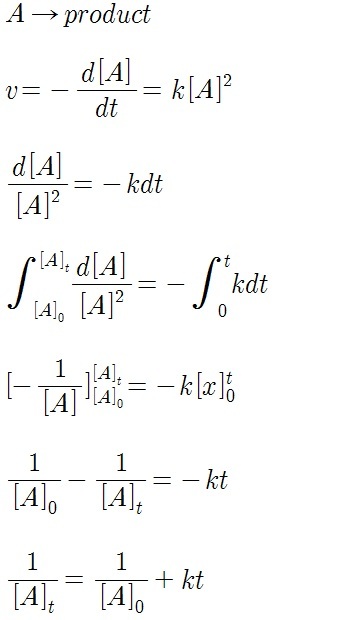
1차 반응에서 반감기를 유도하는 과정과 2차 반응에서 반감기를 유도하는 과정은 완전히 같습니다. 차이가 있다면 적분을 할때 그냥 분수 적분과 제곱 분수 적분의 차이가 있습니다.
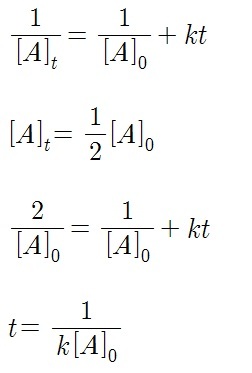
나머지 식을 정리해주면 반감기가 다음과 같이 나옵니다. 2차 반응은 반응이 일어나면 일어날수록 반감기가 길어지는 것을 알 수 있네요!
'공대 공부 > 일반화학' 카테고리의 다른 글
| 표준 환원 전위와 표준 전지 전위 (0) | 2021.08.16 |
|---|
